

发布时间:2025-03-11

考马斯亮蓝染色
在 Western Blot (WB) 实验中,考马斯亮蓝染色是一种常见的染色方法,主要用于评估 SDS-PAGE 电泳和湿转过程的质量。
(考马斯亮蓝SDS-PAGE电泳胶染色)
考马斯亮蓝结构
考马斯亮蓝R-250和G-250染料是二磺酸化三苯基甲烷化合物的两种化学形式,结构上R-250比G-250少了2个甲基。命名上“R”为Red的缩写,因R-250的蓝色染料呈微红色;命名上“G”为Green 的缩写,因G-250的蓝色染料泛浅绿色,也称为胶体考马斯亮蓝(见下文);“250”表示考马斯亮蓝的纯度。
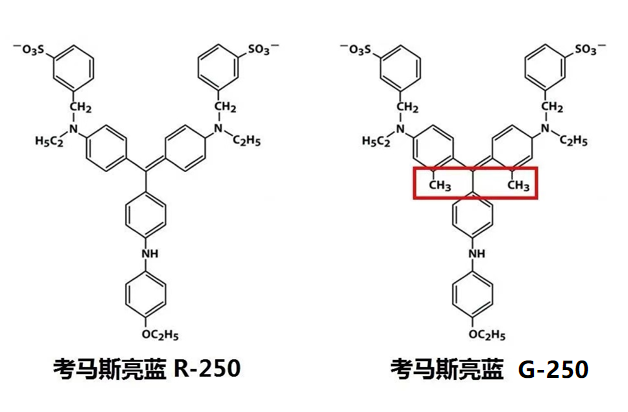
其中R-250因少两个甲基,与蛋白质反应比较缓慢,染色耗时较长,但是容易被洗脱下去,所以常用作凝胶电泳中蛋白质条带染色的基础染料。而G-250因为多两个甲基,与蛋白质的结合反应十分迅速,且形成有色复合体较为稳定,不容易洗脱,常用于蛋白定量的Bradford 法测定试剂;也可染胶,但其脱色时间较长、脱色困难,背景较高,长时间在水中脱色容易使凝胶吸水膨胀甚至破碎。
蛋白质染料要求
用染料和生物大分子结合形成有色的复合物是电泳后检测最常用的方法。选用染料通常应考虑以下要求:
1. 必须与大分子结合以形成一个不溶性的,有色的,紧密的复合物,但不结合到凝胶中和支持膜上,以便从凝胶中除去,否则高背景会影响蛋白带的辨别和定量扫描。
2. 染料必须容易溶解在对大分子没有影响的溶剂中,以利于背景的脱色。
3. 选用高吸光系数的染料有利于提高定量测定的灵敏度。
4. 选用能与大分子有专一性结合的染料,并在结合后能产生不同的颜色(如荧光),可以提高检测的选择性和灵敏度。
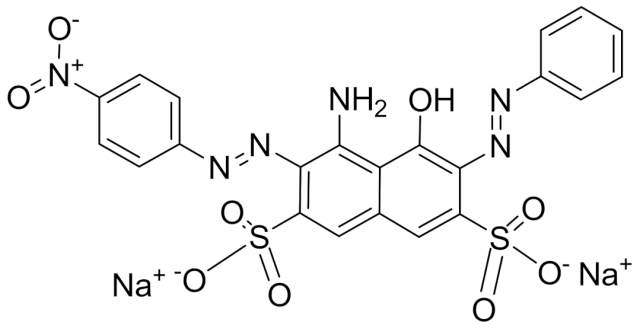
早期用于蛋白染色最常用的染料是氨基黑10B,是一种含有两个磺酸基团的酸性重氮化合物,所以能与碱性氨基酸残基结合进而实现蛋白质染色。但其对SDS-蛋白质染色效果不好;此外,氨基黑10B对不同蛋白质染色时,着色度不等、色调不一(有蓝、黑、棕等);染色灵敏度低,进行凝胶定量扫描时,误差较大。
考马斯亮蓝染料是二磺酸化三苯基甲烷化合物,每个分子也含有两个磺酸基团,也能与碱性氨基酸残基结合进而实现蛋白质染色,其次,还可通过染料的疏水性残基和蛋白质的疏水性区域的作用产生疏水性力,同时也存在氧键和范德华力的作用。考马斯亮蓝染色灵敏度比氨基黑高5倍, 并且适用于SDS-PAGE电泳微量蛋白质染色,此外与不同蛋白结合呈现基本相同的颜色,并且在比较宽的范围内 ,扫描峰的面积与蛋白量有线性关系。
考染的应用
考马斯亮蓝又称为Bradford法,是一种常用的蛋白定性定量分析方法。其主要利用Coomassie Brilliant Blue G-250这种酸性染料与蛋白质在酸性环境下产生吸附,导致染料的最大吸光波长从465 nm变为595 nm。
通过制备不同浓度的牛血清白蛋白标准品液,与Bradford试剂混合后测定其595 nm吸光度值,绘制标准曲线。与标准品同量的样品蛋白溶液与Bradford试剂混合。5 min后在595 nm波长下测定各样品与标准品的吸光度。根据标准曲线,计算出各样品的蛋白浓度。
此外,考马斯亮蓝(Coomassie Brilliant Blue)与丽春红染色一样,也是WB实验中常用的染色方法。通常情况下考马斯亮蓝用于染SDS-PAGE凝胶以评估电泳和转膜条件是否合适(在电泳完成后染色可以根据凝胶上条带的位置形状初步判断蛋白的迁移情况;在电转完成后进行该染色可初步判断蛋白是否有残留,帮助实验人员判断转膜条件是否合适),而丽春红染色则主要用于染膜以初步评估转膜效率及不同组间蛋白表达情况。
Tips
1、考马斯亮蓝染色因高背景,并不推荐PVDF膜或者NC膜的染色;
2、尽管考马斯亮蓝染色可逆,但需要改变染色条件(可能影响SDS-PAGE的稳定性等),因此,SDS-PAGE进行考马斯亮蓝染色后不宜进行下一步的转膜。
在WB(Western Blot)实验中,测膜蛋白浓度不推荐使用考马斯亮蓝法。
考马斯亮蓝法的局限性:膜蛋白通常需要使用特殊的裂解剂(如NaOH或洗涤剂)进行预处理,这些裂解剂可能会影响考马斯亮蓝法的测定结果。
膜蛋白的特殊性:膜蛋白由于其特殊的结构和性质,在提取和测定过程中需要特别注意。膜蛋白通常嵌入在细胞膜中,提取时需要使用特殊的裂解液,这些裂解液中可能含有去污剂等成分,这些成分会干扰考马斯亮蓝法的测定。
因为膜蛋白的水溶性较差,在提取膜蛋白的过程中需加入较多去垢剂,而考马斯亮蓝只能承受溶液中含有微量去垢剂,最大浓度不能超过0.125%,测定结果不准确。
膜蛋白的浓度测定是WB实验中的“隐形门槛”,方法选择不当可能导致后续实验全盘皆输。考马斯亮蓝法虽快捷,却因膜蛋白的疏水性和去垢剂干扰而力不从心。理解原理、优化步骤、做好验证,方能攻克这一技术痛点,为高质量的WB结果保驾护航。