
发布时间:2025-03-18
蛋白免疫印迹
它可是实验室里的“神器”,不仅能帮你估算蛋白的分子量,还能摸清它的表达量。但你知道吗?在跑胶之前,有个关键步叫"煮蛋白"(煮样),它直接决定了你的实验结果靠不靠谱!
煮蛋白的时间可不是随便定的--它会影响蛋白和 SDs 的结合程度、蛋白的变性效果,其至电泳的分辨率。煮得好,条带清晰漂亮;煮不好,结果可能一团糟!
那么问题来了:为什么要煮蛋白?怎么煮才科学?哪些样本必须煮?别急,接下来咱们一起揭开"煮样"背后的秘密!

01
蛋白上样前为什么要进行煮样呢?
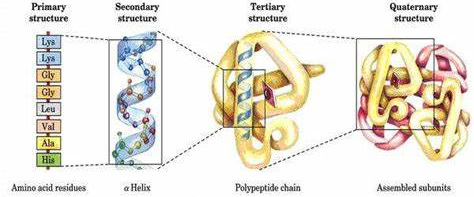
1. 可以破坏蛋白的高级结构
蛋白质的高级结构,包括二级、三级和四级结构,是由一系列非共价键相互作用力所维持的,包括但不限于氢键、疏水键、离子键等。这些复杂的空间结构在电泳分析过程中可能会对蛋白质的迁移速率产生影响,导致实验结构不准确。通过煮沸处理,可以有效地破坏这些非共价相互作用,促使蛋白质的高级结构解离,转变为线性多肽链。在此条件下,蛋白质在电泳过程中的迁移速率将主要取决于其分子量的大小,从而实现更为精确的分子量相关性分析。
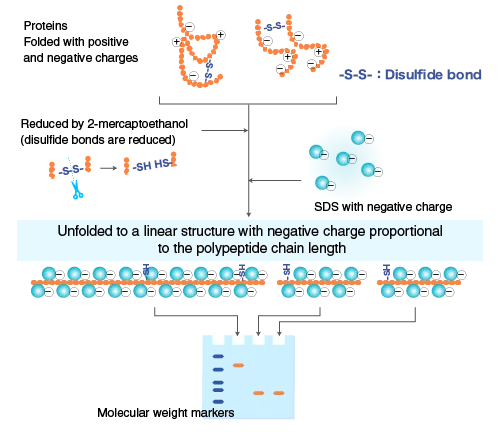
2. 促使SDS与蛋白的充分结合
阴离子去污剂SDS,与蛋白质结合后,可破坏蛋白质结构。主要的作用及破坏机制如下:
破坏疏水作用:SDS的疏水部分(十二烷基链)可以插入蛋白质的疏水核心区域,这些区域通常在水溶性蛋白质中被埋藏在分子内部。这种插入作用破坏了维持蛋白质三级和四级结构的疏水相互作用。
断裂氢键:SDS能够断裂蛋白质分子内和分子间的氢键,这导致蛋白质分子的二级和三级结构被破坏,使蛋白质去折叠。
破坏二硫键:在SDS-PAGE样品处理过程中,通常会加入强还原剂如β-巯基乙醇或二硫苏糖醇(DTT),这些还原剂能够断裂半胱氨酸残基间的二硫键,进一步破坏蛋白质的四级结构。
形成SDS-蛋白质复合物:SDS与蛋白质的疏水部分结合后,会在蛋白质表面形成一层负电荷,这层负电荷的数量远远超过了蛋白质原有的电荷量,从而掩盖了不同蛋白质间的电荷差异。
变性和解聚:在高温处理下,SDS与蛋白质充分结合,使蛋白质完全变性和解聚,形成线性结构,同时带上大量的负电荷,这样蛋白质在电泳中的迁移率主要取决于其分子量,而不是其三维结构。
·
综上所述,SDS通过破坏蛋白质的疏水作用、氢键、二硫键,并形成带有大量负电荷的SDS-蛋白质复合物,从而破坏蛋白质的高级结构,使其变性为一级结构,并在电泳中根据分子量进行分离。
3. 灭活蛋白酶,防止蛋白降解
高温条件下,尤其是煮沸这样的高温处理,会导致蛋白酶的空间结构发生改变,即热变性。这种变性会破坏酶的活性中心,从而影响其催化能力。从而在样品处理中防止了蛋白质的降解。
4. 提高制备蛋白样品的稳定性
高温处理降低蛋白质分子间相互作用力,增强其热稳定性,减少聚集和沉淀。煮沸同时清除样品中的气泡与杂质,保障电泳样品的纯度。
02
蛋白煮样的正确操作方法
首先,将抽取的蛋白量与Loading Buffer按照比例混合,后放置在95~100℃沸水浴中。常规煮样时间是3~5 min,如果样品浓度过高,则可能需要煮10 min或者增加Buffer继续煮。但如果煮样时间过长,蛋白可能会凝固,如蛋白出现明显的沉淀和水分层,则应丢弃,这样的蛋白失去继续进行Western Blot的意义。
上样缓冲液含有甘油,从而使溶液比凝胶电泳缓冲液黏稠,样品容易沉入凝胶上样孔中。上样缓冲液还包含跟踪染料(溴酚蓝),该染料也会在凝胶中迁移,指示电泳迁移距离,显示电泳进展情况。另外就是含有还原剂和DTT,带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异,使蛋白的迁移率仅取决于蛋白质的分子质量的大小。下表说明了蛋白在含有SDS与含有DTT或者βME的情况下,破坏情况。
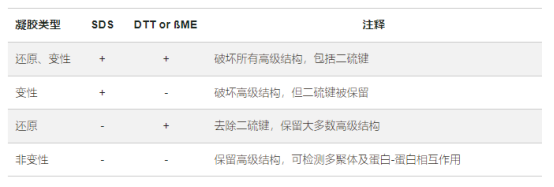
蛋白在不同还原剂与SDS的凝胶中的结构情况
03
哪些样本需谨慎煮样?
1)膜蛋白
对于膜蛋白样品通常不能直接煮沸处理,一般选择37℃放置10min进行蛋白变性处理。
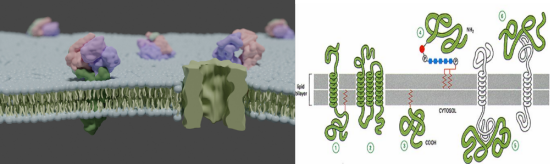
膜蛋白具有特殊的疏水结构,在高温煮沸时容易发生聚集现象,形成二聚体或多聚体,使得蛋白分子量发生变化,导致蛋白检出条带大小或者位置不对;并且可能遮蔽抗体识别表位,导致蛋白无法被抗体识别(结果无信号);蛋白聚集还容易堵塞加样孔口,在泳道上层形成“鬼带”(下层则没有信号/条带)。
但是,不是全部膜蛋白都会出现这种情况。膜蛋白是否煮样,需要进行预实验(可根据蛋白的属性,在50-70℃之间进行热变性)。如果膜蛋白煮样后,跑胶结果出现拖带、堵孔、鬼带”、弥散、蛋白大小不对的情况,就需要谨慎处理了。
2)热敏感蛋白
有些蛋白对温度较为敏感,如线粒体蛋白、溶酶体蛋白或者热休克蛋白等,高温可能导致蛋白聚集或者降解,此类蛋白不适合煮样。可采用37℃放置10-30min的方法进行处理。
04
煮样后样本该如何保存?
煮样后的样品应尽快使用,如果实在需要保存,可以分装成小份保存在-20℃或-80℃冰箱(不建议4℃保存),避免反复冻融。保存半年以上的样品再次使用前需补加适量的还原剂重新煮样后再使用。
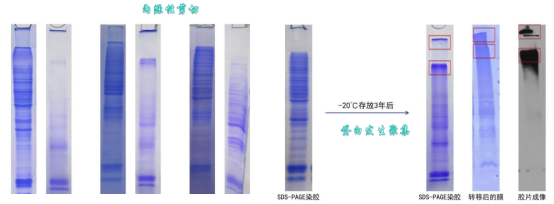
煮样后样本若经过长时间保存,一是易发生内源性剪切,部分蛋白降解;二可能会蛋白发生聚集,形成了复合物,从而堵塞浓缩胶和分离胶加样孔口。所以建议请勿长时间保存处理好的样本。