衰老是一种增龄伴随的机体功能衰退的过程,是众多人类慢性疾病的主要风险因素。抵抗衰老是人类永恒的话题。
近年来,随着对生物学研究的加深,我们逐渐意识到,衰老细胞在人类的衰老进程中起到了关键作用,也因此成为了一个潜在的抗衰老靶点。
细胞衰老是一种稳定的细胞周期停滞。随着时间的推移或面临外界应激压力时,细胞的正常生理功能和增殖能力发生逐渐地衰退,从而脱离细胞周期的过程。
衰老细胞分泌多种因子,统称为衰老相关分泌表型(senescence-associated secretory phenotype,SASP),驱动了衰老相关的组织功能障碍。
线粒体功能障碍是细胞衰老的一个标志,先前的研究表明,当衰老细胞中线粒体耗尽时,SASP的产生会急剧下降。然而,其潜在的机制尚未阐明。
2023年10月11日,来自美国梅奥诊所的João F.Passos团队和英国格拉斯哥大学的Stephen W.G.Tait团队合作在Nature上发表了题为Apoptotic stress causes mtDNA release during senescence and drives the SASP的研究论文。
该研究发现凋亡应激导致衰老过程中mtDNA的释放,激活了cGAS-STING,并驱动SASP的分泌。

线粒体在细胞凋亡(一种不同于细胞衰老的细胞命运)中起着重要作用,这一过程涉及到线粒体外膜透化(MOMP),依赖于BAX或BAK,导致细胞快速死亡,细胞凋亡还伴随着BAX/BAK依赖的mtDNA释放到细胞质中。
值得注意的是,2015年初,英国格拉斯哥大学Stephen W.G.Tait团队一项研究发现,低剂量细胞凋亡剂处理的细胞时,MOMP以极低的水平发生,但没有诱导细胞凋亡,他们将这一现象命名为minority MOMP(miMOMP)。
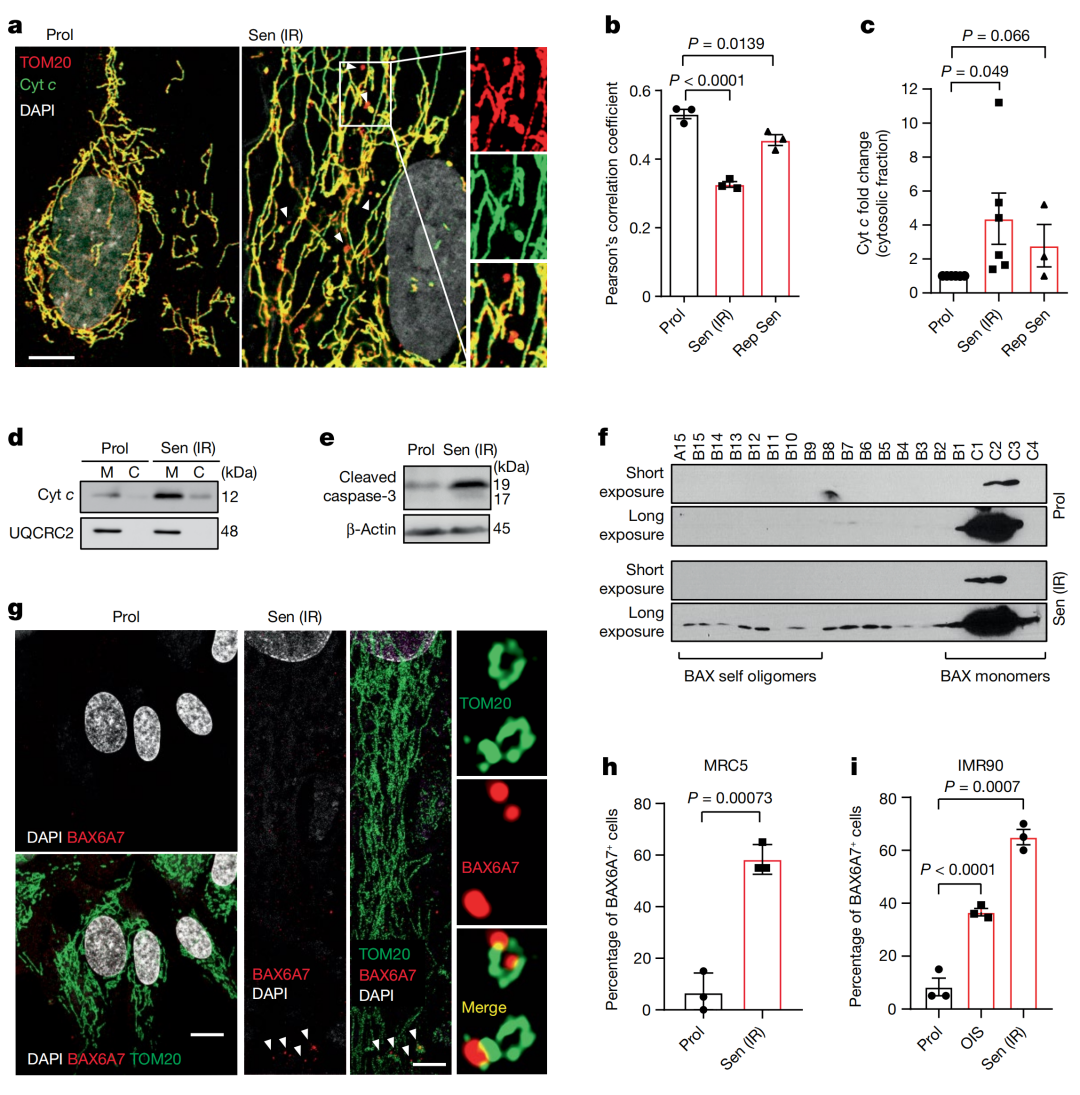
该研究中,研究人员首先研究了miMOMP是否是细胞衰老的一个特征。
通过分析线粒体外膜蛋白TOM20和细胞色素c(Cyt c)在增殖或衰老的人成纤维细胞中的共定位关系,研究人员,在增殖细胞中,Cyt c和TOM20共定位,但在衰老细胞中,出现了一部分外周线粒体,这些线粒体已经从网络中分离并呈现出球形结构,这些线粒体对TOM20呈阳性反应,但对Cyt c呈阴性反应。
研究还发现,在辐射诱导的衰老细胞(Sen IR)和复制性衰老细胞中,Cyt c和TOM20的共定位减少。
此外,衰老细胞胞质中Cyt c和裂解的caspase-3含量增加,以及BAX的激活。
这些数据都表明衰老期间部分线粒体会发生miMOMP。
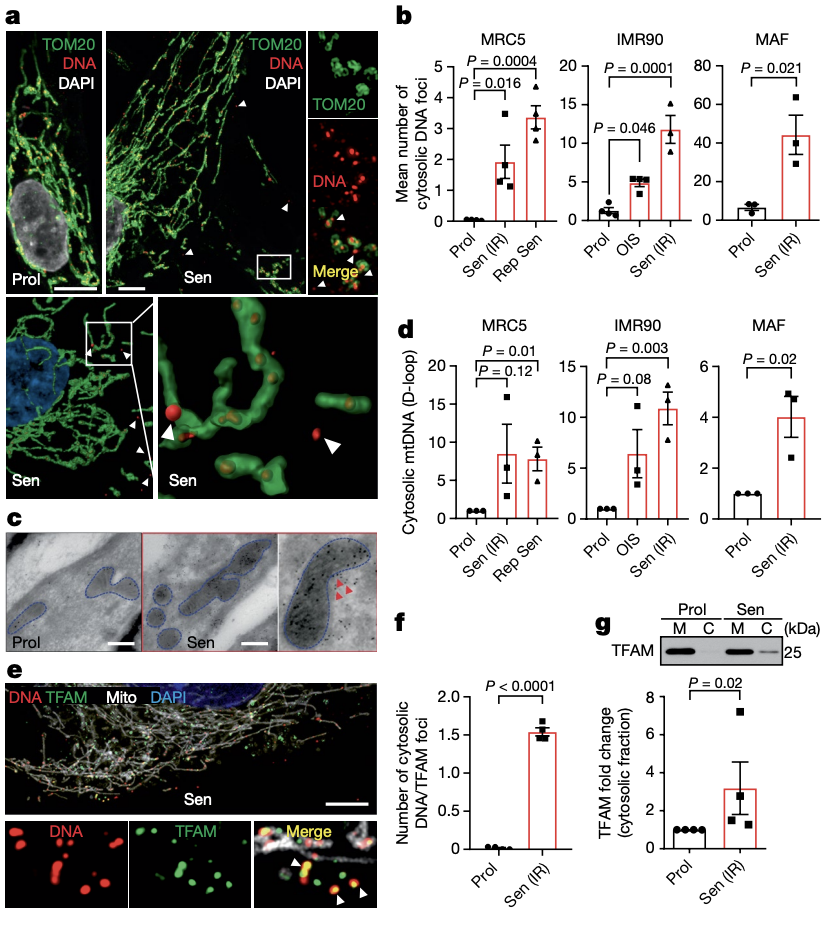
 由于,在凋亡过程中,MOMP导致线粒体DNA(mtDNA)释放到胞质中,于是研究人员假设正在经历miMOMP的线粒体可能也会释放mtDNA到衰老细胞的胞质中。
通过免疫荧光和免疫电镜等多种方法,研究人员发现衰老细胞中mtDNA被释放到胞质中,而这些胞质中的mtDNA与转录因子TFAM(一种mtDNA包装蛋白)存在相关性。
由于,在凋亡过程中,MOMP导致线粒体DNA(mtDNA)释放到胞质中,于是研究人员假设正在经历miMOMP的线粒体可能也会释放mtDNA到衰老细胞的胞质中。
通过免疫荧光和免疫电镜等多种方法,研究人员发现衰老细胞中mtDNA被释放到胞质中,而这些胞质中的mtDNA与转录因子TFAM(一种mtDNA包装蛋白)存在相关性。
 鉴于衰老相关分泌表型(SASP)是细胞衰老的典型特征。接下来,研究人员想要探究miMOMP和SASP之间的关系。
通过ABT-737(一种针对抗凋亡BCL-2蛋白的BH3类似物)处理细胞,研究人员发现,即使在不导致细胞死亡的低浓度下,ABT-737也能显著增加IL-6和IL-8的分泌,以及相关mRNA的表达,从而推动细胞衰老的进程。
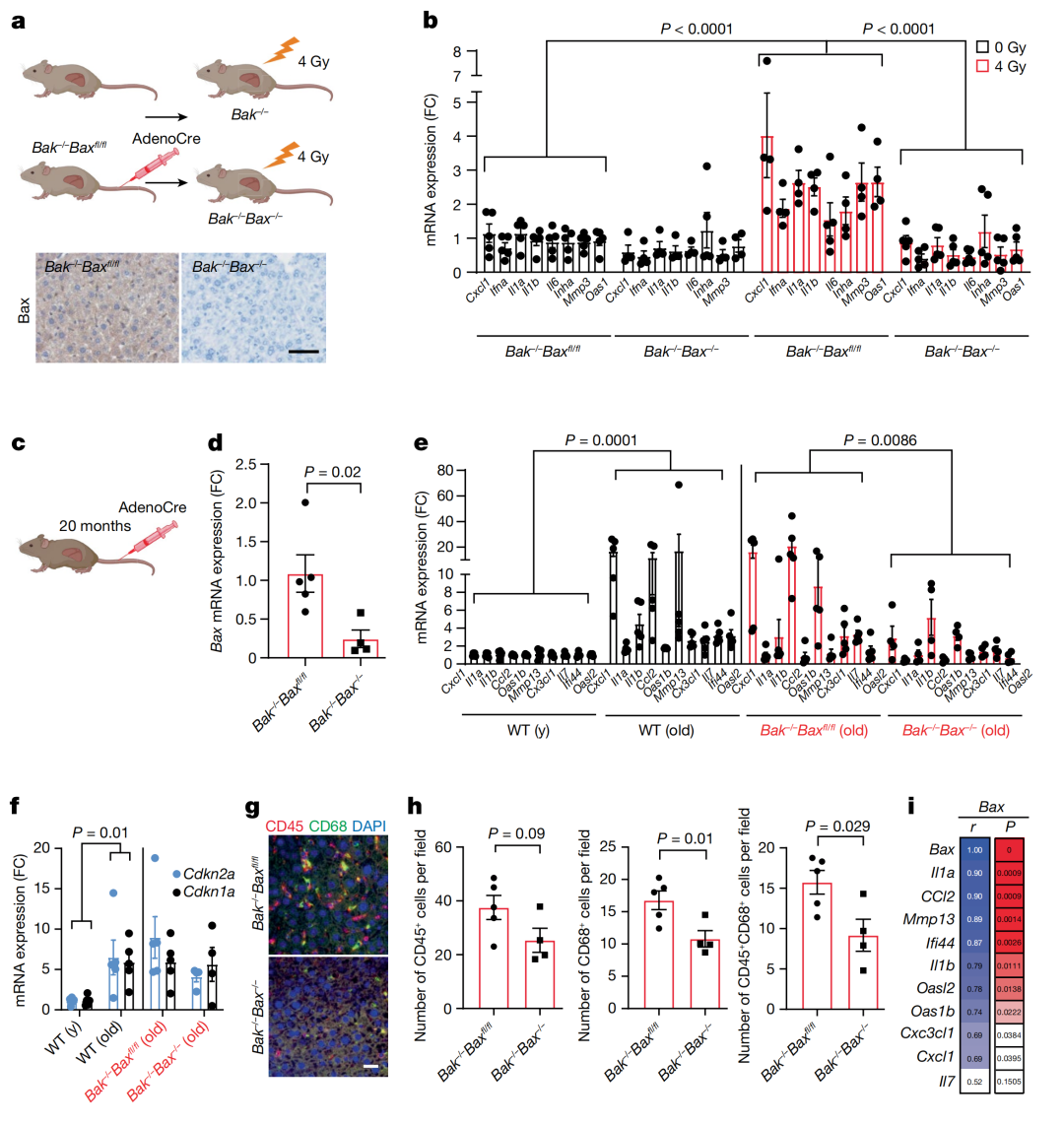
深入研究发现,mtDNA的释放依赖了MOMP必不可少的两种蛋白质BAX和BAK形成的大孔。
当BAX和BAK这两种蛋白同时被敲除时,衰老细胞中mtDNA和SASP的释放被抑制。
进一步RNA测序表明,BAX和BAK调节SASP,但不调节与衰老相关的细胞周期阻滞。
团队进一步在辐射诱导衰老小鼠模型进行了研究,肝脏和老龄化骨组织中复现了上述结果。
这些数据表明,miMOMP对体外和体内SASP的形成都有贡献。
鉴于衰老相关分泌表型(SASP)是细胞衰老的典型特征。接下来,研究人员想要探究miMOMP和SASP之间的关系。
通过ABT-737(一种针对抗凋亡BCL-2蛋白的BH3类似物)处理细胞,研究人员发现,即使在不导致细胞死亡的低浓度下,ABT-737也能显著增加IL-6和IL-8的分泌,以及相关mRNA的表达,从而推动细胞衰老的进程。
深入研究发现,mtDNA的释放依赖了MOMP必不可少的两种蛋白质BAX和BAK形成的大孔。
当BAX和BAK这两种蛋白同时被敲除时,衰老细胞中mtDNA和SASP的释放被抑制。
进一步RNA测序表明,BAX和BAK调节SASP,但不调节与衰老相关的细胞周期阻滞。
团队进一步在辐射诱导衰老小鼠模型进行了研究,肝脏和老龄化骨组织中复现了上述结果。
这些数据表明,miMOMP对体外和体内SASP的形成都有贡献。
 随后,研究人员研究了miMOMP是如何驱动SASP的。
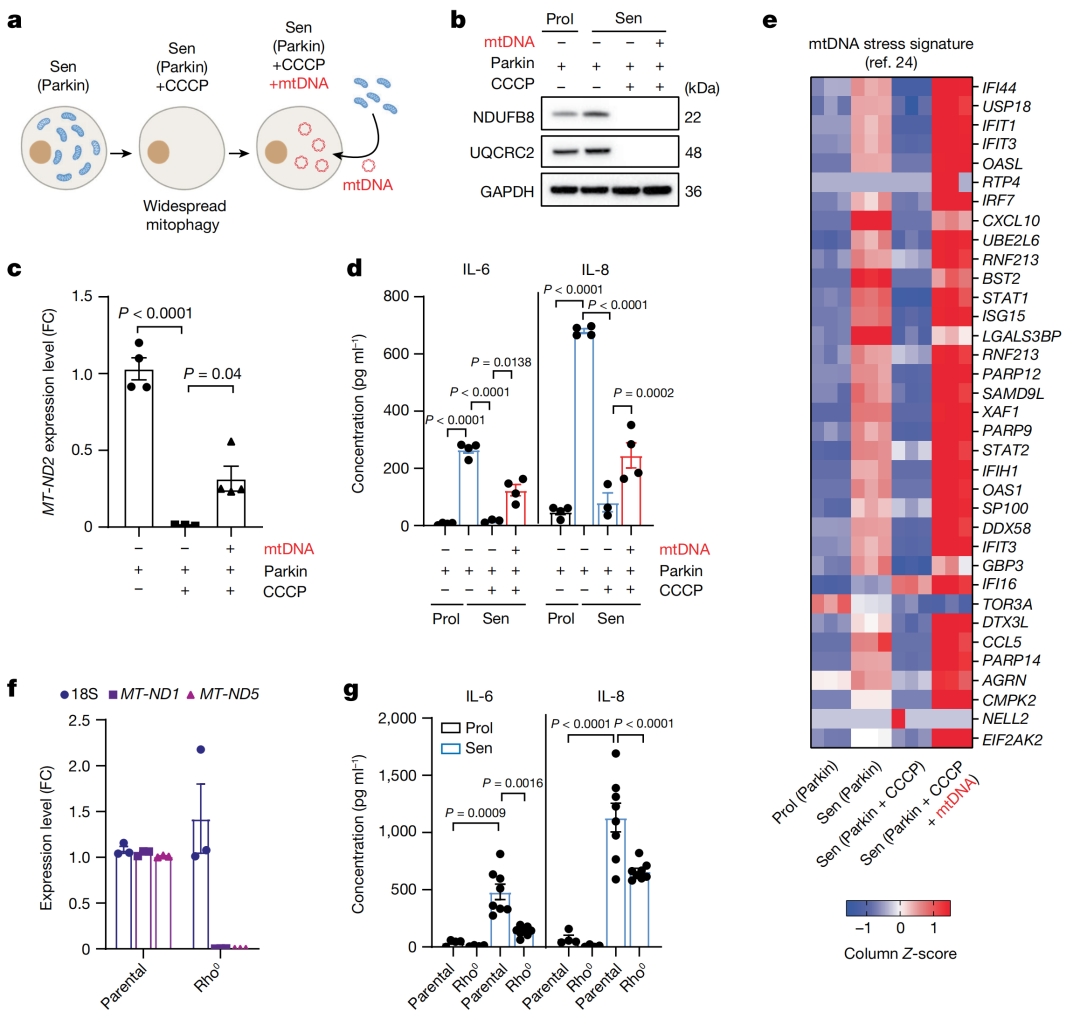
他们将注意力集中到mtDNA的释放。为了验证miMOMP诱导的胞质mtDNA是否也能激活cGAS-STING通路,研究人员通过表达Parkin蛋白以及CCCP处理诱导细胞激活mitophagy(线粒体自噬)反应从而清除线粒体,随后再转染mtDNA激活cGAS-STING。
经过这一系列的操作,研究人员发现衰老细胞中线粒体清除后,常见SASP因子IL-6和IL-8的分泌被抑制,而重新转染mtDNA可以部分恢复这一分泌。
此外,mtDNA的应激状态还影响了一组干扰素刺激基因(ISGs)的表达,这些ISGs在细胞老化时上调,但在线粒体清除后下调,然后在重新引入mtDNA后再次上调。
进一步的实验表明,缺乏mtDNA也导致SASP组分IL-6和IL-8的显著减少,并且cGAS和STING信号通路的介入会影响SASP的调控。
在小鼠胚胎成纤维细胞中的研究进一步支持了这一发现,Tfam缺陷加速了细胞老化和炎症,而STING抑制剂可以减少炎症因子的表达。
这些结果强调了mtDNA、cGAS和STING在细胞老化和SASP调控中的关键作用。
那又是什么因素诱导了衰老细胞中miMOMP的产生?
通过IP-MS鉴定BAX的互作蛋白主要功能为线粒体动态、能量代谢和脂质功能等,这暗示着衰老引起的BAX激活可能改变了线粒体动态。
为了验证这个假设,研究人员首先利用活细胞成像,发现在衰老细胞中线粒体分裂的速率要低于增殖细胞。
此外,老化细胞中的线粒体普遍表现出高度融合的网络结构,只有少数线粒体呈现解离或碎片化状态。
进一步的研究揭示,只有那些圆形且碎片化的线粒体(TOM20+)在老化细胞中会发生miMOMP,从而释放mtDNA。
这些发现引发了一个假设,即在老化细胞中,线粒体动力学出现高度融合态,可能是一种抑制miMOMP和mtDNA释放的机制。
于是,研究人员通过分子手段干扰或敲除线粒体融合基因mitofusion-2(MFN-2)破坏线粒体的融合动态,miMOMP和SASP的数量增加了。此外,使用卡邦基氰基m-氯苯基水合肼(CCCP)等化学物质诱导老化细胞中的线粒体分裂也会加剧mtDNA释放和SASP的发生。
也就是说,衰老过程中线粒体过度融合可能是阻止miMOMP和mtDNA释放的一种机制。
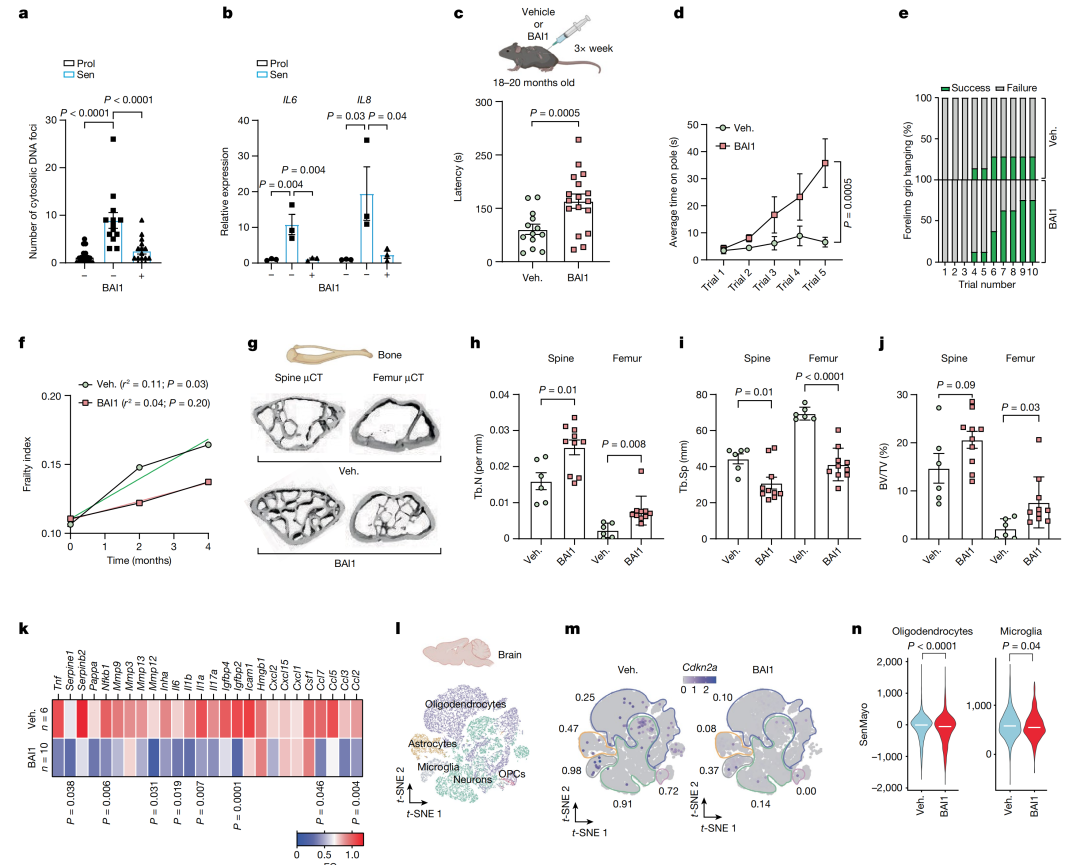
研究的最后,研究人员进行了药物和治疗意义的探究,评估了使用MOMP的药物抑制剂是否可以抑制mtDNA的释放和SASP的产生。
利用BAX的抑制剂BAI1抑制衰老细胞中BAX的激活,研究人员发现mtDNA的释放和SASP的产生都受到了显著抑制。
此外,通过体内实验,研究人员发现抑制MOMP可减少炎症标志物,改善老年小鼠的健康状况。
这些结果表明,抑制miMOMP可能是改善老化相关的炎症和细胞老化的治疗策略。
综上,Tait团队和Passos团队的这项研究表明,线粒体外膜通透化(MOMP)不仅与细胞凋亡有关,还与细胞老化和炎症有关,通过将mtDNA释放到细胞中中激活cGAS-STING通路,在细胞衰老中驱动无菌炎症。
最重要的是,研究表明,抑制miMOMP可能是抵消与年龄相关的无菌性症,因此,靶向miMOMP可能是一种改善健康寿命的有前景的策略。
随后,研究人员研究了miMOMP是如何驱动SASP的。
他们将注意力集中到mtDNA的释放。为了验证miMOMP诱导的胞质mtDNA是否也能激活cGAS-STING通路,研究人员通过表达Parkin蛋白以及CCCP处理诱导细胞激活mitophagy(线粒体自噬)反应从而清除线粒体,随后再转染mtDNA激活cGAS-STING。
经过这一系列的操作,研究人员发现衰老细胞中线粒体清除后,常见SASP因子IL-6和IL-8的分泌被抑制,而重新转染mtDNA可以部分恢复这一分泌。
此外,mtDNA的应激状态还影响了一组干扰素刺激基因(ISGs)的表达,这些ISGs在细胞老化时上调,但在线粒体清除后下调,然后在重新引入mtDNA后再次上调。
进一步的实验表明,缺乏mtDNA也导致SASP组分IL-6和IL-8的显著减少,并且cGAS和STING信号通路的介入会影响SASP的调控。
在小鼠胚胎成纤维细胞中的研究进一步支持了这一发现,Tfam缺陷加速了细胞老化和炎症,而STING抑制剂可以减少炎症因子的表达。
这些结果强调了mtDNA、cGAS和STING在细胞老化和SASP调控中的关键作用。
那又是什么因素诱导了衰老细胞中miMOMP的产生?
通过IP-MS鉴定BAX的互作蛋白主要功能为线粒体动态、能量代谢和脂质功能等,这暗示着衰老引起的BAX激活可能改变了线粒体动态。
为了验证这个假设,研究人员首先利用活细胞成像,发现在衰老细胞中线粒体分裂的速率要低于增殖细胞。
此外,老化细胞中的线粒体普遍表现出高度融合的网络结构,只有少数线粒体呈现解离或碎片化状态。
进一步的研究揭示,只有那些圆形且碎片化的线粒体(TOM20+)在老化细胞中会发生miMOMP,从而释放mtDNA。
这些发现引发了一个假设,即在老化细胞中,线粒体动力学出现高度融合态,可能是一种抑制miMOMP和mtDNA释放的机制。
于是,研究人员通过分子手段干扰或敲除线粒体融合基因mitofusion-2(MFN-2)破坏线粒体的融合动态,miMOMP和SASP的数量增加了。此外,使用卡邦基氰基m-氯苯基水合肼(CCCP)等化学物质诱导老化细胞中的线粒体分裂也会加剧mtDNA释放和SASP的发生。
也就是说,衰老过程中线粒体过度融合可能是阻止miMOMP和mtDNA释放的一种机制。
研究的最后,研究人员进行了药物和治疗意义的探究,评估了使用MOMP的药物抑制剂是否可以抑制mtDNA的释放和SASP的产生。
利用BAX的抑制剂BAI1抑制衰老细胞中BAX的激活,研究人员发现mtDNA的释放和SASP的产生都受到了显著抑制。
此外,通过体内实验,研究人员发现抑制MOMP可减少炎症标志物,改善老年小鼠的健康状况。
这些结果表明,抑制miMOMP可能是改善老化相关的炎症和细胞老化的治疗策略。
综上,Tait团队和Passos团队的这项研究表明,线粒体外膜通透化(MOMP)不仅与细胞凋亡有关,还与细胞老化和炎症有关,通过将mtDNA释放到细胞中中激活cGAS-STING通路,在细胞衰老中驱动无菌炎症。
最重要的是,研究表明,抑制miMOMP可能是抵消与年龄相关的无菌性症,因此,靶向miMOMP可能是一种改善健康寿命的有前景的策略。